TAREA 1
Buenos dias alumnos: desde hoy se subirán 2 actividades semanales que realizarán previa lectura de las páginas indicadas de su libro. Si lo necesitan pueden ver videos o tutoriales que les iré dejando en la página principal según crea conveniente, pero recuerden que la mayoría de estos contenidos los vieron en Ciencias Naturales el año pasado. Cualquier duda solo dejen su comentario y se los responderé a la brevedad.
No olviden dejar por cada actividad un comentario, si tienen dudas con la pregunta o de lo contrario con solo su nombre y apellido para ir llevando el control de su participación y cumplimiento. Una vez que se reanuden las clases, se hará una clase de consulta general y luego se evaluarán los contenidos que se han visto en este período. Bueno... aclarado el panorama comencemos con nuestra primera actividad.
- A continuación de la pagina 41 realizar en una hoja un cuadro sinóptico como el de la página 37 pero donde agreguen a la clasificación ya realizada de los materiales según su origen, la clasificación según su estado físico
- Investiguen de que manera nosotros podemos elaborar en forma artesanal, en nuestra casa, de una manera fácil y económica ALCOHOL EN GEL, como una manera de solucionar la escases que en estos momentos estamos viendo y lo explican a continuación del cuadro anterior
- Lean la pag 42, 43 y 44 y realiza la actividad 9 " que no es la del libro" sino que tiene la siguiente consigna:
- En la misma hoja en el que elaboraron el cuadro sinóptico y la investigación, mencionen ejemplos en el cual ustedes utilicen sus sentidos ( gusto, tacto, vista, oído y olfato) para clasificar la materia prima a utilizar o para calificar el producto elaborado. Dos ejemplos por cada sentido, es decir deben mencionar 10 ejemplos en total. ( ejemplo: utilizo el sentido de la vista para diferenciar la fruta madura de la que no lo está.....)
TAREA 2
- lean la pagina 46 y realicen la actividad 10 en una hoja que colocarán a continuación de la pag 47
- Mirar el video de la materia y sus propiedades que esta en la página principal y realizar a continuación de la actividad 10, un cuadro sinóptico
- Lean las pag. 48, 49 50 y 51 y realicen una breve síntesis de no más de una carilla de lo leido en una hoja que colocarán después de la pag 51
Solo fue dejar en el blog el correo
TAREA 4
TAREA 4
- De la actividad 4 de la pag 63 solo responde el item a)
- La actividad 5 se hará cuando se retome el cursado ( no hacer)
- Raliza las lecturas de las pag 65,66, 67, 68 y 69 (Repaso de lo ya estudiado el año anterior!!)
- De la actividad 6 de la pag 70 solo responde el item a)
- Lee las pag 70, 71 y 72 , 73, 74, 75 y 76 no resolver la actividad 7 del libro , en su lugar , resolver la siguiente actividad como ACTIVIDAD 7
- Entre Lunes y Martes deben enviar a mi correo marielalapenna@gmail.com las actividades 4,5,6,y 7 para ser evaluadas
CLASIFICA LOS SIGUIENTES SISTEMAS EN HOMOGÉNEOS O HETEROGÉNEOS E INDICA DE QUE MANERA SEPARARÍAS LOS DIVERSOS COMPONENTES DE LOS SIGUIENTES EJEMPLOS
- agua y aceite
- agua y sal disuelta
- agua y alcohol
- ripio y arena
- limaduras de hierro y aserrín
- agua sucia con tierra
- corcho rallado y arena
- azúcar y harina
Recuerda que los métodos físicos que puedes utilizar son: tamización, filtración, decantación, destilación, flotación, disolución, imantación o separación magnética, evaporación
TAREA 5
SUSTANCIAS Y SOLUCIONES
Leer la pag 79, 80, 81, 82 y 83 y realiza la ACTIVIDAD 11 de la pag 83
Luego lee desde la pag 84 a la 90 y con ayuda de un mayor (hermano, papis, abuelos o alguien que este con ustedes en casa) traten de hacer la actividad 12. Tal vez puedan hacerlo solitos pero pueden que necesiten ayuda.
Les dejaré un video para que puedan tener una MEJOR comprensión del tema
ACTIVIDAD OPTATIVA
Después como actividad extra piensa e inventa un ejemplo de:
Después como actividad extra piensa e inventa un ejemplo de:
- solución diluida
- solución concentrada
- solución saturada
- solución sobresaturada (investiga en que que casos sucede)
Y en cada ejemplo menciona cual es el soluto y cual es el solvente
TAREA 6.
Lee las páginas 92 a 96 y responde la ACTIVIDAD 14 de la pag 96 del libro
Lee las pag 97 a 99 y responde la ACTIVIDAD 15 de la pag 99 del libro
y por último lee las paginas 100,101 y 102
Realiza una lectura minuciosa de las páginas 173 a la 182 y responde:
• CuO
• Br2O3
• Al2O3
• N2O5
• FeO
• MgO
• CaO
• PbO
• Óxido de nitrógeno (III),
• Óxido de cloro (VII)
• Anhídrido clórico
• Anhídrido fosforoso
• Óxido de sodio
• Anhídrido carbónico
• Óxido áurico
• Óxido de cinc



ACTIVIDAD 19: Resolución del trabajo práctico integrador compartido por el grupo de wpp
TAREA 7 ( última actividad del Capítulo 2)
- Lee las páginas 106, 107,108 y 108 y realiza un cuadro sinóptico con los aportes que hicieron a los largos de la historia, Boyle, Dalton y Berzelius
- Responde el siguiente cuestionario que te servirá de guia de estudio para la siguiente exámen:
- Defina sistema material
- ¿Qué diferencia existe entre un sistema homogéneo y heterogéneo?
- Defina fase
- Menciona 3 métodos físicos se pueden utilizar para separar componentes de un sistema homogéneo y 3 métodos físicos que utilizaría para separar sistemas heterogéneos, dando un ejemplo para cada caso
- Defina sustancia y sus características
- Defina solución y diferencie los 3 tipos de soluciones, diluída, concentrada y saturada
- Defina soluto y solvente y dé 3 ejemplos de soluciones diferenciando el soluto del solvente
- Defina solubilidad y diga como varía esta con la temperatura
- ¿Qué es un modelo?
- ¿Qué relación hay entre la energía cinética de las moléculas y los distintos estados de agregación de la materia? (sólido, líquido y gaseoso)
- Defina molécula y átomos
- ¿Que simbolizan las letras y los números en una fórmula química? De 2 ejemplos
- ¿Qué diferencia existe entre sustancias naturales y sintéticas? de un ejemplo de cada una
- ¿Qué diferencia existe entre sustancias inorgánicas y orgánicas? de un ejemplo de cada una
- ¿Qué diferencia existe entre sustancias simples y compuestas? de un ejemplo de cada una
TAREA 8: Cambios físicos y químicos y el papel de la energía
Lee las paginas 114 a 117 del capítulo 3 y resuelve las ACTIVIDADES 1 y 2 de la pagina 118
- Lee las páginas 119 a 120 y resuelve la ACTIVIDAD 3
- Lee las páginas 121 a 125 y resuelve las ACTIVIDADES 4 y 5
- Luego lee las páginas 127 a 129 y realiza la actividad 6, para ello deberás consultar a un mayor para que te asesore y te ayude a elaborar una respuesta que para todos los alumnos es individual y personal
- Por último avanza con las lecturas de la página 130 a 132 y realiza la ACTIVIDAD 7
TAREA 9: Reacción química: reactivos y productos. La combustión
Lee las páginas 133 a 138 y realiza el siguiente cuestionario en reemplazo de la actividad 8
Investiga:
- ¿Qué es una ecuación química?
- Defina reactivos y productos
- ¿Que es una combustión? ¿Son endo o exotérmicas? Nombre los reactivos que intervienen
- Represente la ecuación química de una combustión completa y una incompleta y exprese sinteticamente las diferencias entre ambas
- En las ecuaciones puede verse al carbono representado así C pero al oxígeno interviniente así O2. Explique por qué
- ¿Cómo es la combustión del gas natural? represente mediante una ecuación química
- Si en la combustiones se forma agua. ¿no debería verse?
- ¿Las estufas son peligrosas? ¿Por qué?
TAREA 10: Ley de conservación de la masa
Ahora chicos haremos un pequeño salto a la pagina 158 de nuestro libro. Recordemos que hemos conocido algunas reacciones químicas, como la de combustión, en la cual hemos reconocido reactivos y productos de la reacción. Dentro de los reactivos algunos elementos químicos se presentan en la naturaleza como monoatómicos (C) y otros como diatómicos(O2), eso es lo que llamamos atomicidad (números de átomos que forman una molécula)
Ahora bien,
- leeremos las páginas 158 a 160 y responderemos la actividad 13 de la pag 161
- Leeremos las páginas 162 a 165 y copia en tu hoja el cuadro sinóptico sobre transformaciones químicas que está en la página 165
- Escribe la definición de QUÍMICA que también esta en la pagina 165 del libro
- y por último lle las páginas 166 a 169 y extrae 10 ideas principales de lo leído, entre ellas las de Lavoisier, ( no se aceptarán tareas en donde los alumnos se copien este último punto)
Asi terminamos el tercer capítulo y debemos consultar dudas para que el próximo Miércoles 20 de Mayo podamos hacer la evaluación del capítulo. Comprenderían las TAREAS 8, 9 y 10
TAREA 11:
CAPÍTULO 4: Los elementos químicos
Realiza una lectura minuciosa de las páginas 173 a la 182 y responde:
- ¿Cómo pueden agruparse las sustancias según su descomposición y según su origen?
- Redacta una oración donde vincules los distintos términos: átomo- elemento- molécula- sustancia
- ¿Cuantos elementos químicos hasta ahora son conocidos? ¿Cuántos son naturales y cuántos artificiales? ¿Que significa que sean ARTIFICIALES?
- ¿De qué manera se representan los elementos químicos? ¿Con qué criterio fueron elegidos sus nombres?
- De todos los ejemplos que figuran en la pag 176 y 177 ¿La etimología de qué elemento químico te llamó mas la atención y por que?
- Busca en casa, en alguna enciclopedia o en internet una tabla periódica de los elementos químicos y dime de que manera se clasifican los elementos químicos según sus características fisico-químicas?
- Menciona las características de metales, no metales y gases nobles
- Realiza en una hoja a parte, una tabla como la que te grafico a continuación, que posea tres columnas que digan, NOMBRE DEL ELEMENTO, SÍMBOLO QUÍMICO y NÚMERO DE OXIDACIÓN y completarás la primera columna con el nombre del elemento químico que corresponda al símbolo que figure en la segunda columna
- NOMBRE DEL ELEMENTOSÍMBOLO QUÍMICONÚMERO DE OXIDACIÓNHLiNaKAgBeCaMgBaZnFOFAlBHgCuAuNPPtPbClBrIFeCoNiS
9. Andá memorizando los símbolos químicos por que dentro de poco se tomará lección oral a cada alumno por video llamada
TAREA 12:
La tabla periódica de los elementos químicos y el modelo atómico
- ¿En qué consiste la tabla periódica de los elementos químicos?
- ¿De qué forma están ordenados los elementos químicos en la tabla?
- Investiga en diferentes fuentes y luego realiza una breve síntesis sobre la historia de la tabla periódica, ¿como surgió?, ¿hubo uno o varios intentos?, ¿fue el trabajo de uno solo o de varios científicos?
- Los elementos químicos están ordenados según su masa atómica creciente o según su número atómico creciente? ¿Por que se ordeno de esa y no de la otra forma?
- Dibuja en tu hoja una tabla periódica señalando numero de grupos y períodos y pintando con diferente colores al hidrógeno, los metales, no metales y gases nobles o inertes.
- ¿Por qué razón al hidrógeno se lo separa de los demás grupos?
- Resuelve las actividades 3 y 4 de la pagina 193
- ¿Cómo es un átomo?
- ¿Qué partículas forman un átomo, cual es su masa, su carga y donde se ubican dentro del átomo?. Copia en tu hoja el cuadro comparativo de la página 201
- ¿Qué representa el número atómico y el número másico del átomo de un determinado elemento representado en la tabla periódica? Escribe un ejemplo diferente a los mencionado en la página 202
- Lee la página 203 y responde¿por qué razón los electrones(-)no son atraídos hacia el núcleo (+)
- ¿Cómo se distribuyen los electrones alrededor del núcleo?
- ¿Cuántos niveles y subniveles pueden haber como máximo en un átomo ¡
- ¿Qué es la configuración electrónica?
- ¿Qué importancia tienen los electrones ubicados en el último nivel de energía de un átomo?
- Resuelve la Actividad 6 de la página 204
- ¿Qué similitudes hay entre los átomos de los elementos ubicados en un mismo grupo en la tabla periódica?entonces: ¿Qué me indica o con que coincide el número de grupo ?
- ¿Qué similitudes hay entre los átomos de los elementos ubicados en un mismo período en la tabla periódica? Entonces:¿Qué me indica o con que coincide el número de período ?
- ¿Qué es la estabilidad química, quienes la poseen y quienes no y por que?
- ¿Qué diferencia hay entre elementos representativos y de transición?
TAREA 13:
Niveles y subniveles de energía. Electrones de valencia, Configuración electrónica
- ¿Qué son los niveles de energía y Cuantos niveles de energía puede tener como máximo un átomo?
- ¿Qué capacidad para contener electrones tiene el nivel 1, 2, 3 y 4?
- ¿Que tipo de orbitales o subniveles podemos encontrar en el nivel 1,2,3 y 4?
- Dibuja la forma de un orbital Sy de un orbital P
- ¿Cuántas orientaciones espaciales tiene un orbital s, los p. los d y los orbitales f?
- ¿Que es la configuración electrónica de un átomo?
- ¿Que es el esquema o regla de Hund y para que se utiliza?
- Realiza la configuración electrónica de los siguientes átomos: H, Be, Al, Ar, Ca y Cu
- Ahora saca tus propias conclusiones a partir de la resolución del ejercicio anterior y responde
- ¿En que termina la configuración del elemento del grupo IA?
- ¿En que termina la configuración del elemento del grupo IIA?
- ¿En que termina la configuración del elemento del grupo IIIA?
- ¿En que termina la configuración del elemento del grupo VIIIA?
- ¿En que termina la configuración del único elemento de transición propuesto?
10 En función a lo respondido ¿Qué relación existe entre los grupos mencionados y los subniveles incompletos?
11 ¿A qué denominamos electrones de valencia y que relación tiene con la valencia o número de oxidación de los elementos?
TAREA 14
Enlaces Químicos
- ¿A qué se denomina unión química?
- ¿Por qué los gases no reaccionan? Enuncia la Ley o teoría del octeto electrónico
- ¿En qué consiste la representación de un átomo por DIAGRAMA DE LEWIS?
- Defina la unión iónica, entre que tipo de átomos se establece y y como sucede. Dibuje el ejemplo de unión iónica que se dá entre el Na y el Cl
- Defina que entiende por catión y anión
- ¿Cuándo un elemento se señala como electropositivo y cuando como electronegativo?
- Defina la unión covalente, entre que tipo de átomos se establece y y como sucede. Dibuje el ejemplo de unión covalente que se dá entre el C y el O
- ¿De qué manera puede representarse la unión entre el C y el O pero mediante diagrama de barras?
- ¿Qué es la polaridad? explique brevemente
- Defina la unión metálica y explique en función a ello por qué los metales son buenos conductores
Puedes ayudarte con el libro, en el blog he dejado videos que te orientarán y siempre puedes consultarme ante una duda por el blog o por el grupo de wpp
SEGUNDO CUATRIMESTRE
CAPÍTULO 5
ACTIVIDAD 15
CAPÍTULO 5
ACTIVIDAD 15
EN ESTE SEGUNDO CUATRIMESTRE VARIAREMOS UN POCO LA MODALIDAD QUE VENIMOS IMPLEMENTANDO, SERÁN LOS ALUMNOS QUIEN EXPLIQUE CADA CLASE Y A VER COMO NOS VA!!!!
Para el jueves necesito que 4 alumnos se graben haciendo una video corto, de no mas de 5 min donde explique algunos de los siguientes temas:
- Como se representa una reacción química por medio de una ecuación química (señalando reactivos, productos,etc) por ejemplo en la formación de óxidos
- Qué son los óxidos y como se nomenclan y formulan, teniendo en cuenta el número de oxidación de los elementos que los forman
- Como se equilibra una ecuación química
- Como se calcula las masas moleculares de los reactivos presentes en cada ecuación química
CUESTIONARIO
Luego de ver los videos que elaboraron sus compañeros sobre estos temas y con la teoría explicada en el libro (pag 237 a 240), respondan el siguiente cuestionario
- ¿De qué manera se representa una reacción química? dé un ejemplo
- ¿Qué son los óxidos y como se clasifican?
- Investiga usos de un oxido básico y un óxido ácido (o anhídrido) que se haga en la industria o comercio
- Sabiendo como se nombran los óxidos básicos formula o nomencla los siguientes ejemplos según corresponda:
- óxido de sodio
- óxido de calcio
- óxido de aluminio
- óxido cuproso
- óxido férrico
- K2O
- MgO
- Au2O3
5. Sabiendo como se nombran los óxidos ácidos según la nomenclatura tradicional o por stock, formula o nomencla los siguientes óxidos
- anhídrido bromoso
- anhídrido sulfúrico
- dióxido de carbono
- pentóxido de dinitrógeno
- I2O7
- P2O3
- Cl2O
6. A continuación plantea las ecuaciones químicas de formación de los 3 primeros óxidos del punto 4 y los 3 primeros óxidos del punto 5 y equilíbralas
7. Por últimos calcula las masas molares de reactivos y productos en cada ecuación, revisando que se cumpla la "Ley de conservación de la masa", por lo que la suma de masa de todos los reactivos sea igual a la masa del producto obtenido
8. ¿Qué representa el número de Avogadro?
LA ACTIVIDAD DEBE SER ENTREGADA COMPLETA ANTES DEL 18 DE AGOSTO. a PARTIR DE ESA FECHA EN ADELANTE SE CONSIDERARÁ ENTREGADA FUERA DE TÉRMINO
ACTIVIDAD 16: Los hidróxidos
• CuO
• Br2O3
• Al2O3
• N2O5
• FeO
• MgO
• CaO
• PbO
• Óxido de nitrógeno (III),
• Óxido de cloro (VII)
• Anhídrido clórico
• Anhídrido fosforoso
• Óxido de sodio
• Anhídrido carbónico
• Óxido áurico
• Óxido de cinc
2.Plantea la ecuación de síntesis para todos los óxidos y equilibra las mismas
3. Calcula las masas molares en las 3 primeras ecuaciones
4. Nombra o formula los siguientes hidróxidos según corresponda
• LiOH
• Cu(OH)2
• Cr(OH)3
• Al(OH)3
• Mg(OH)2
• AgOH
• Fe(OH)2
• NaOH
• Ca(OH)2
• Pb(OH)4.
• Hidróxido auroso
• Hidróxido mercúrico
• Hidróxido cobáltico
• Hidróxido férrico
• Hidróxido de niqueloso
• Hidróxido platinoso
• Hidróxido de potasio
5. Elige tres óxidos básicos del ejercicio 1, combínalos con agua y obtén su hidróxido respectivo. Todo eso represéntalo mediante una ecuación química equilibrada, por ejemplo si elijo el óxido plúmbico deberé formar el hidróxido plúmbico de la siguiente manera

6. Calcula las masas molares de reactivos y productos de esas 3 ecuaciones y verifica que se cumpla con la "Ley de conservación de la masa y los elementos químicos"
Esta actividad se recibirá hasta el lunes 31 de agosto
ACTIVIDAD 17: Los óxidos e hidróxidos ( Compuestos binarios y ternarios)
REPASO GENERAL
Luego de ver el video que les compartí en donde explico el tema óxidos e hidróxidos, deberán completar en forma individua, los siguientes ejercicios preparándonos para la próxima evaluación el MIÉRCOLES 16 de setiembre
- Formula o nomencla los siguientes compuestos según corresponda
- FeO
- hidróxido de cinc
- Cu(OH)2
- AuOH
- P2O5
- SO3
- Pt(OH)2
- óxido mercúrico
- anhídrido peryódico
- hidróxido crómico
- Li2O
2. Plantea la ecuación de síntesis para los siguientes compuestos, equilibra y cacula sus masa molares
- óxido niquélico
- anhídrido bromoso
- hidróxido plúmbico
La actividad debe ser entregada a mas tardar el viernes 4 /09
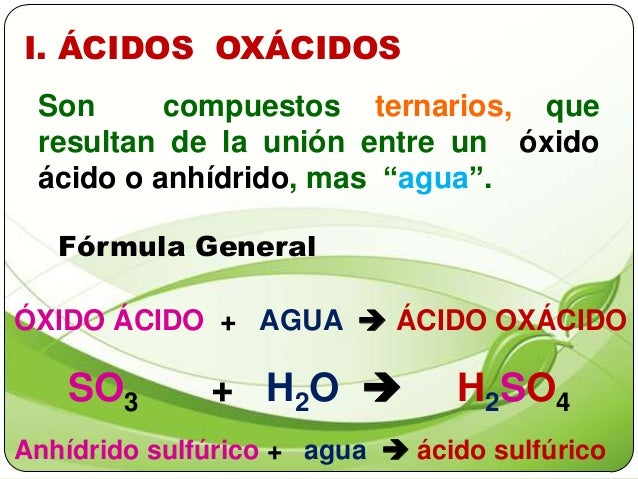
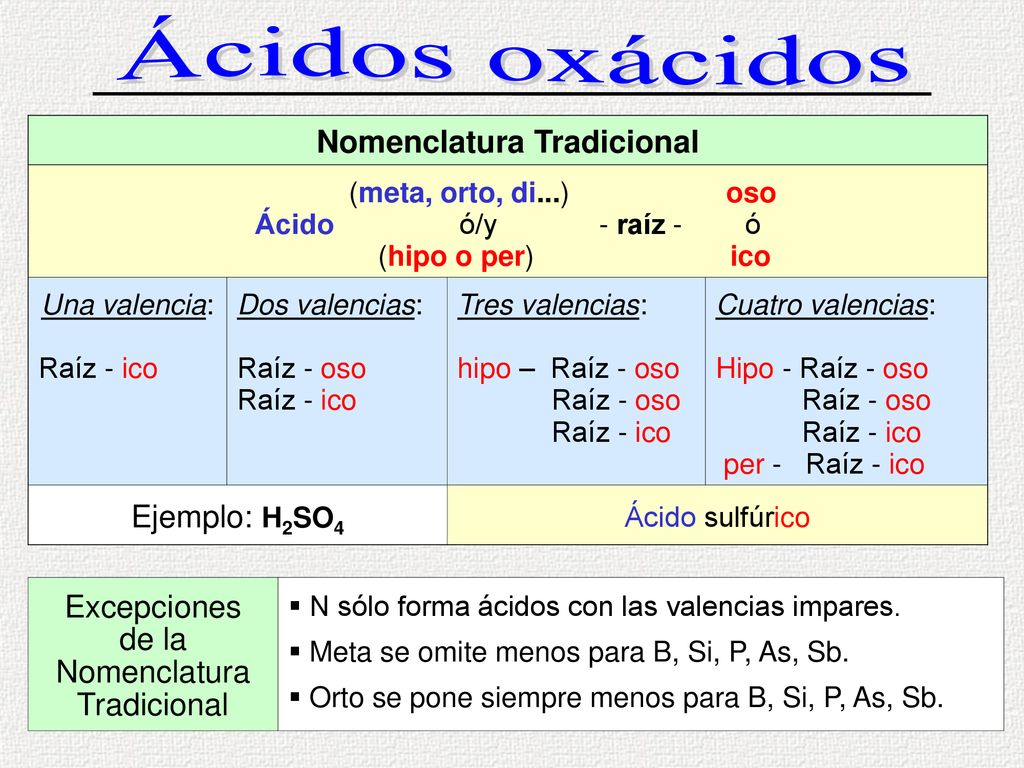
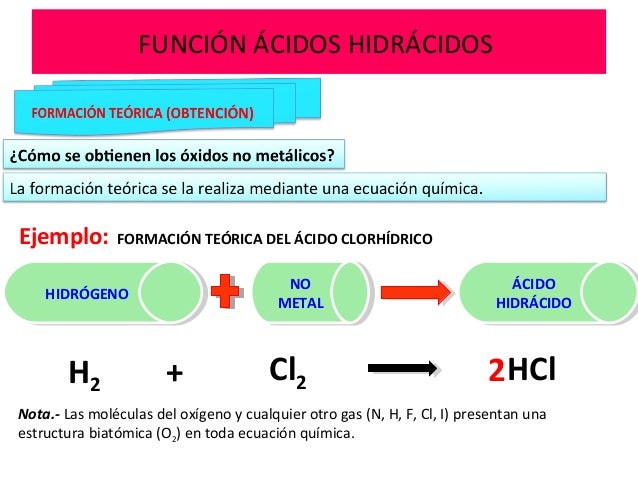
ACTIVIDAD 18: Los ácidos

Dentro de los ÁCIDOS podemos distinguir : Los OXÁCIDOS y los HIDRÁCIDOS
Ecuación de síntesis de los OXÁCIDOS


Ecuación de síntesis Y nomenclatura de los HIDRÁCIDOS


Ejercitación:
- Formula o nomencla los siguientes ácidos :
- HF
- ácido sulfhídrico
- ácido carbónico
- HClO
- ácido nitroso
- H2SO3
- ácido perbrómico
2. Plantea las ecuaciones de síntesis de cada ácido del ejercicio anterior , equilibra y calcula sus masas molares
ACTIVIDAD 20 :Reacciones de neutralización. Las sales
- ¿ Qué diferencia existe en cuanto a su estructura, entre una reacción de síntesis, de descomposición y de neutralización?
- Defina que entiende por reacción de neutralización
- ¿Qué es una sal y que propiedades poseen?
- ¿Qué tipo de reacciones posibles y entre que tipo de compuestos me llevarían a obtener una sal?
- Investiga 5 sales de uso común
- Con el listado de oxoaniones que se compartió en el grupo y recordando los números de oxidación de los cationes, escribe la fórmula de las siguientes sales:
- nitrito de potasio
- carbonato de sodio
- sulfato de calcio
- hipoclorito de magnesio
- fluoruro de plata
- coruro de aluminio
- ácido clórico + hidróxido de cinc
- hidróxido férrico + ácido hipobromoso
- ácido iohídrico + hidróxido cúprico
- hidróxido de aluminio + ácido sulfuroso
ACTIVIDAD 21 : Las sales - Estequiometría
- Formula la sal correspondiente y luego plantea la ecuación de neutralización que la origina según los posibles casos, colocando el agua como producto en las ecuaciones posibles:
- Perbromato ferroso (combinando el ácido con el hidróxido correspondiente)
- sulfito cuproso (combinando el óxido básico con el ácido correspondiente)
- nitrato de plata (combinando el óxido básico con el óxido ácido correspondiente)
- carbonato de aluminio (combinando el anhídrido u óxido ácido con el hidróxido correspondiente)
- ioduro de cinc ( combinando el hidrácido con el hidróxido correspondiente)
- Plantea la ecuación de neutralización correspondiente con reactivos y productos según se mencionan en el enunciado del problema
- Equilíbrala y calcula sus masa molares
- Plantea una con regla de tres simples y calcula su respuesta
- masa de ácido que se necesitan para tal reacción
- masa de sal que se forma
- moles de agua obtenido
- moles de anhídridos necesarios para tal reacción
- Masa de sal obtenida
No hay comentarios:
Publicar un comentario